胰腺(pancreas)包含内分泌和外分泌腺,深度参与消化和代谢平衡(图1)[1]。内分泌胰岛(islets)分泌胰高血糖素和胰岛素进入血液控制血糖。外分泌腺由胰腺导管(duct)和腺泡(acini)构成,后者储存和分泌消化酶进入十二指肠参与蛋白质、淀粉、脂肪等的消化。
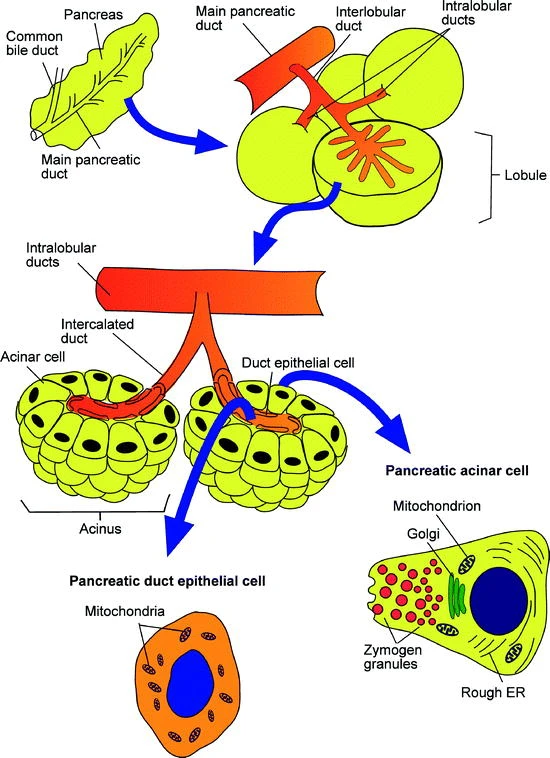
图1:胰腺的结构
(来源:参考资料[1])
临床和医学研究中,如何获得合理的胰腺模型已成为长久的困扰。采取胰腺活检的手段易出现并发症,临床风险较高。手术标本来源的胰腺则受制于独特的病理特征,丢失了正常胰腺组织的生理数据。另一方面,基于啮齿动物等的体内模型存在培养耗时久、成本高昂等桎梏。此外,来自永生化细胞系或原代细胞的2D培养模型则缺乏细胞极性、细胞间作用、细胞与细胞外基质间作用等重要数据。
相较而言,类器官作为一种通过细胞自组织产生的3D细胞集合体,可以模拟来源组织原始的结构和功能,表征胰腺表观遗传、转录组和蛋白质组等水平的分子特性,已经逐渐成为胰腺研究重点平台。2025年1月16日,加州大学微生物与分子遗传学系研究团队在期刊Experiment & molecular medicine发表综述性论文“Advancing pancreatic cancer research and therapeutics: the transformative role of organoid technology”,对胰腺导管腺癌类器官的历史、技术、应用等进行了全面阐述。综合该文,Organoids总结了胰腺类器官从培养到应用的全方位参考,详细举例了成体组织来源、病理来源的类器官培养要点,并对当下胰腺癌类器官的困局与重点改良方向进行了探讨。

(来源:参考资料[2])
01 胰腺类器官的建立
胰腺起源自内皮层前肠上皮的两个不同区域,在发育过程中受中胚层动态信号的调控,且当胰腺祖细胞特化后,中胚层间充质细胞还会聚集成为胰腺间充质,深度参与胰腺器官发生。因此,胰腺是包含内胚层和中胚层来源细胞的多组织器官,受上皮-间充质转化作用影响,具有高度异质性(图2)[3]。长期以来,由于其分子发育机制复杂不明晰,从干细胞获得胰腺类器官存在困难。
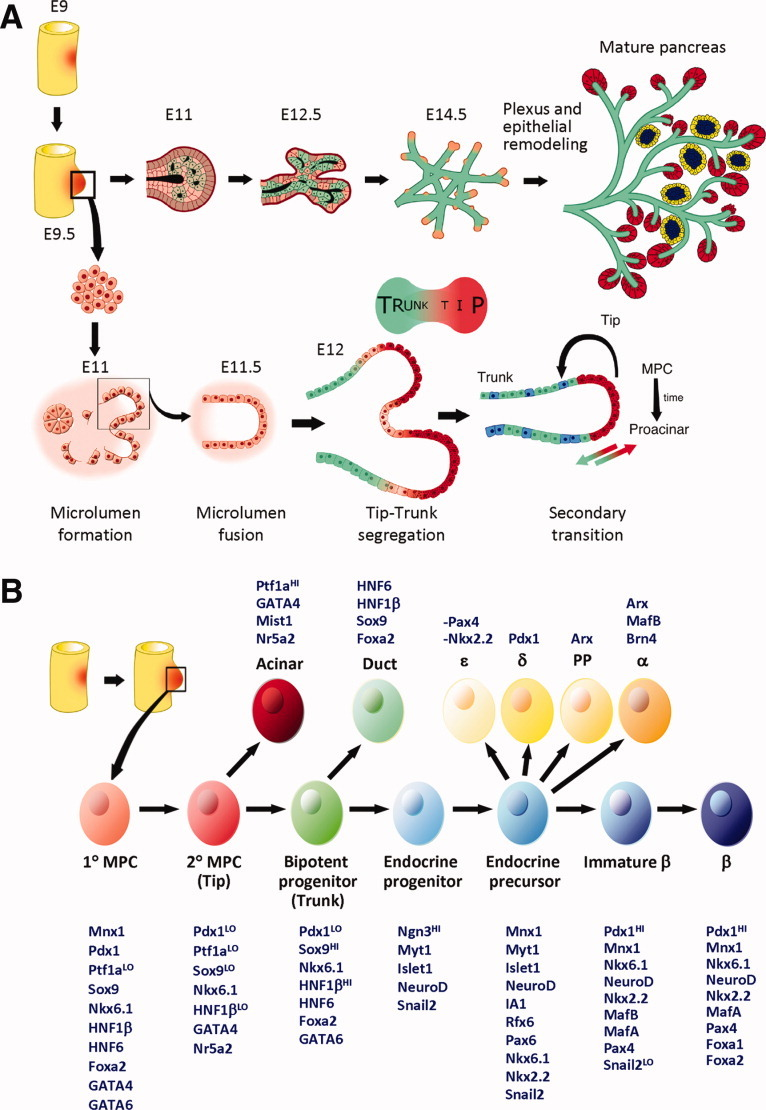
图2:小鼠胰腺器官发生示意图
(来源:参考文献[3])
胎儿组织来源
2012年,瑞士洛桑联邦理工学院团队首次证明,胚胎小鼠胰腺祖细胞可以培养为具有三系(腺泡,导管和内分泌)分化潜力的自组织3D结构[4]。此前,少量分离的胰腺祖细胞最多只能维持存活几天。该团队在实验中发现,来自间充质的成纤维细胞生长因子10(FGF10)有助于胰腺祖细胞的维持和扩增,同时还会减少腺泡分化。与此同时,FGF1也参与限制内分泌分化,而对扩增、分支或外分泌分化没有显著影响(图3)[4]。
该研究表明,胰腺祖细胞的体外维持和扩增需要活性Notch和FGF信号传导以重现体内微环境信号传导相互作用。在培养后期,则需要从培养基中去除FGF1并抑制FGF信号传导,以抑制间充质信号传导,从而促进内分泌细胞的形成。
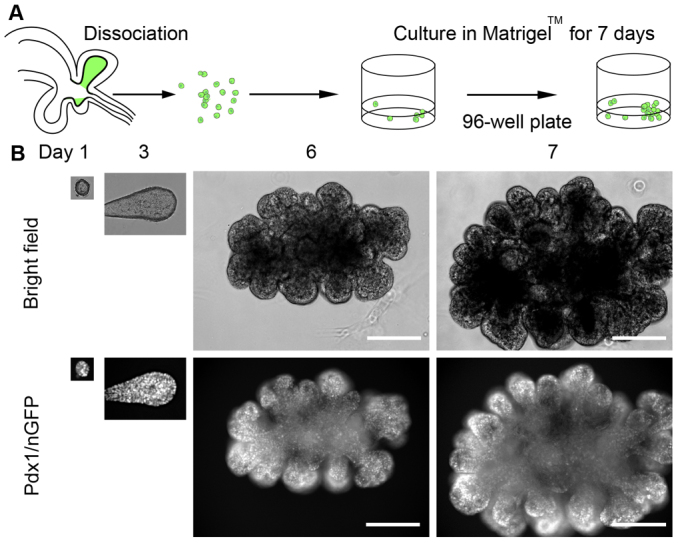
图3:胎儿组织来源胰腺类器官的体外扩增和形态发生
(来源:参考文献[4])
FGF / novoprotein
FGF是一类普遍存在于哺乳动物体内的促细胞分裂肝素结合蛋白,其与受体FGFR及下游的信号转导参与了胰腺、肺、心脏、泌尿系统、脑、骨骼、肌肉、皮肤、血管以及淋巴管等几乎所有器官的发育,此外在神经调节、代谢调节中也有重要作用。除FGF10参与胰腺类器官的生成以外,FGF家族还广泛参与肺、胃、肝脏、心脏等多种类器官的培养。
近岸蛋白提供一系列经过多种类器官模型体外培养验证的高活性、高批间一致性的FGF家族重组蛋白。
成人组织来源
尽管胎儿胰腺祖细胞来源的类器官已经在胰腺发育的研究中已经取得了很大进展,然其获得难度及伦理问题还是阻碍了更为广泛的应用。相较而言,成人组织拥有更丰富的组织干细胞来源,且成人胰腺具有部分再生能力。
再生过程中,Lgr5可作为导管的标志物。而Lgr5同时也是WNT激动剂R-spondin的辅助受体。事实上,来自成年小鼠胰腺的导管部分可在添加有R-spondin的体外培养基中启动Lgr5表达,并继续在补充有EGF、FGF10的条件下生成类器官。移植至肾包膜下后,该胰腺类器官可进一步诱导分化为导管和内分泌细胞(图4)[5]。
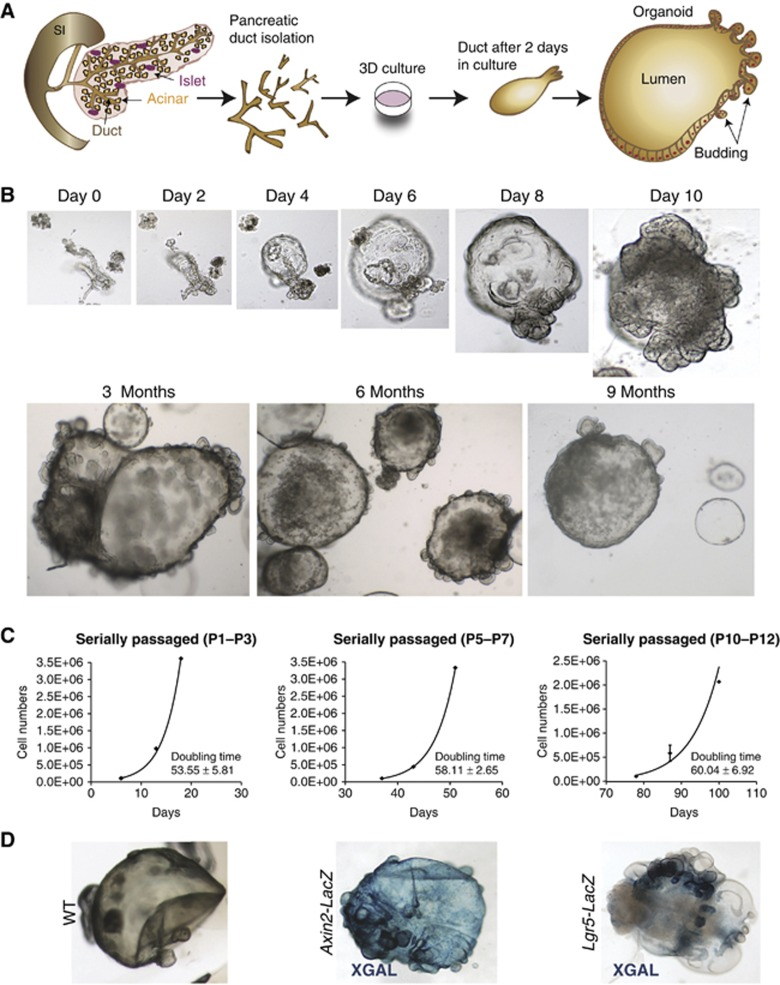
图4:成人胰腺导管类器官的建立
(来源:参考文献[5])
WNT刺激对于胎儿组织来源的类器官培养同样有效。比利时和法国研究团队通过添加WNT激动剂R-Spondin1,FGF10和EGF等细胞因子,成功使来自人类胎儿胰腺组织的胰腺祖细胞保持扩增长达5个月[6]。研究还发现,EGF信号在促进小鼠和人胚胎胰腺祖细胞的体外扩增同时抑制内分泌分化[7]。
总之,在组织来源的胰腺类器官培养中,FGF、WNT及EGF的添加对于胰腺祖细胞的扩增至关重要。
干细胞来源
2015年,加拿大多伦多大学的研究者们通过WNT、Notch、TGF-β和Hedgehog通路的调控及复杂的生长因子组合,首次从人胚胎干细胞(hESC)衍生的胰腺祖细胞获得了具有腺泡和导管结构的胰腺上皮类器官(图5)[8]。与前述类似,该研究发现,抑制TGF-βRI(TGF-β受体I)和Notch可促进分化成导管和腺泡,而Hedgehog抑制和WNT激活在诱导阶段II和III阻碍了向胰腺谱系的分化,需要在培养过程中施加进一步的调控。
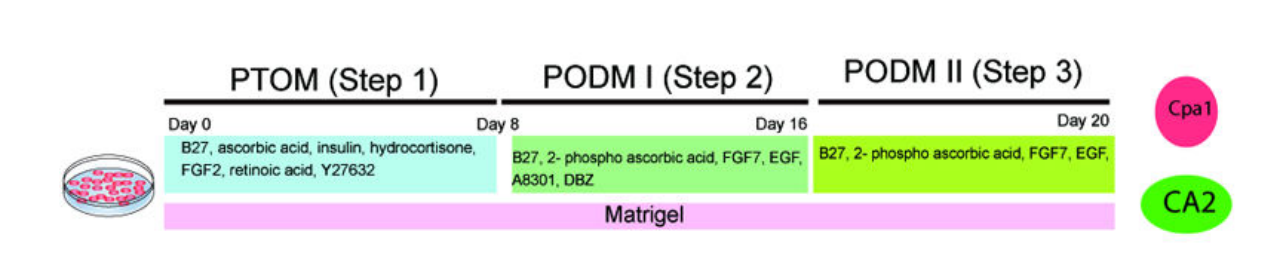
图5:hESC来源胰腺类器官的分化方案
(来源:参考文献[8])
不过,对于内分泌的胰岛而言,WNT4会作为代谢成熟因子,在完全化学成分确定的培养基中促进功能性人类胰岛样类器官(HILO)的产生[9]。
病理来源
95%的胰腺癌发生在外分泌腺,尤其是胰腺导管腺癌(PDAC),由于诊断晚、治疗效果差,已成为最致命的恶性肿瘤之一。2016年,Hans Clevers和其团队从正常和PDAC小鼠和人胰腺组织分别建立了类器官模型(图6)[10]。在人肿瘤组织来源的培养基中,研究团队添加了TGF-β抑制剂A83-01,用于增殖的R-Spondin1、WNT-3a、以及胰腺再生期间的形态发生原EGF、FGF10等。而人正常胰腺类器官的培养中,研究人员则额外添加了前列腺素PGE2以进一步促进其增殖。最终获得的类器官可在体外保持扩增、传代,并不发生恶性转化超过十个月。原位移植到小鼠胰腺后,这些类器官可产生导管结构。
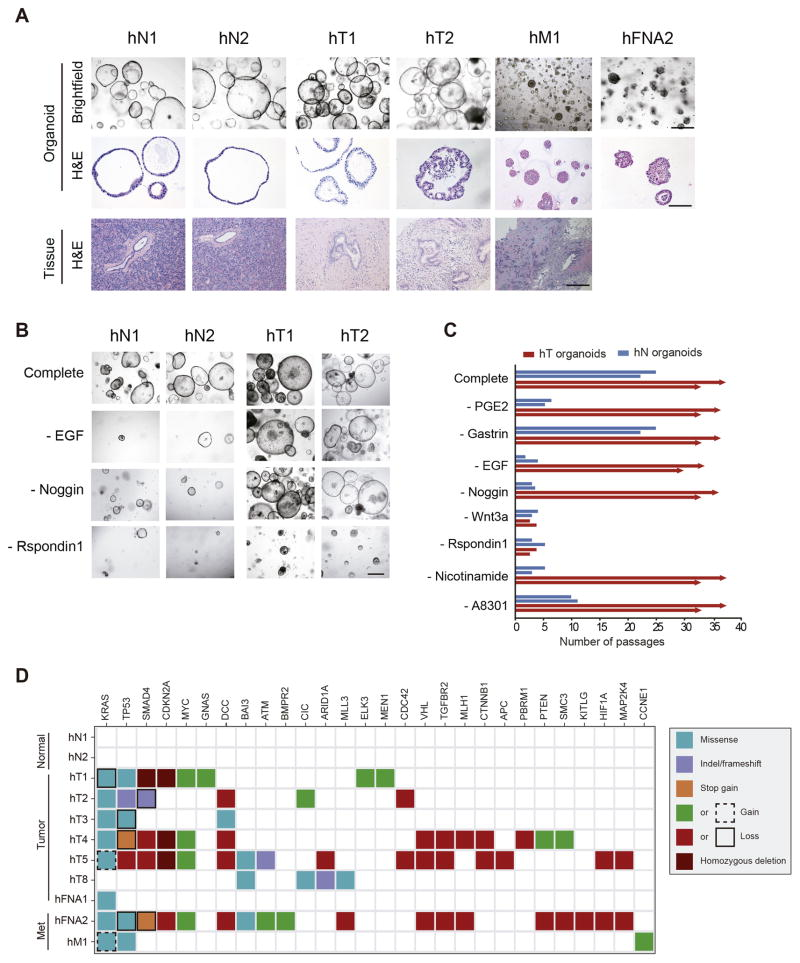
图6:Hans Clevers团队建立的人胰腺导管类器官概括了正常和肿瘤导管的特征
(来源:参考文献[10])
02 胰腺癌类器官的优势
除病理来源的类器官以外,值得注意的是,从成人胰腺分离得到的人类正常胰腺导管类器官也拥有参与病理研究的价值。本综述中作者着重提到,虽然正常胰腺导管细胞增殖能力有限,但人类正常胰腺类器官拥有与肿瘤细胞类似的增殖速率,在保持扩增能力的同时并没有积累恶性突变,因此可作为与肿瘤细胞对比研究差异化表达基因等肿瘤特征的平台。
此外,胰腺类器官可以从极少的组织样品中建立,因而跨越了胰腺癌确诊晚、仅有20%胰腺癌患者适合手术切除造成的缺乏研究样本的障碍。
总之,与难以保持上皮特征的2D细胞系相比,3D胰腺类器官可保留基底-顶端极性并建立有细胞骨架。患者来源的类器官(PDO)概括了体内肿瘤的细胞状态并可捕获体细胞遗传和个体间变异以及肿瘤微环境特征,为研究胰腺癌生物学和探索潜在的治疗策略提供了一个生理学相关的平台(图7)[11]。
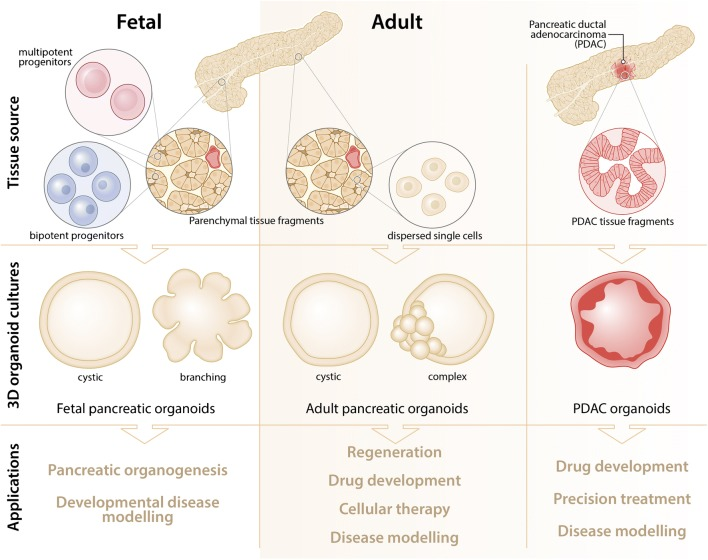
图7:胰腺类器官的产生与应用
(来源:参考文献[11])
03 临床应用
如前所述,PDO已成为理想的药物疗效预测和耐药性评估平台。2024年法国研究团队的前瞻性研究表明,PDAC类器官特异性为92.9%、灵敏度为83.3%,在临床环境下具有稳健的预测价值[12]。且来源于患者的类器官保留了个体特征,允许对药物反应进行动态追踪评估。此外,PDO还允许大规模地对患者样品进行多组学分析,以揭示用于预测药物反应的不同标志物。
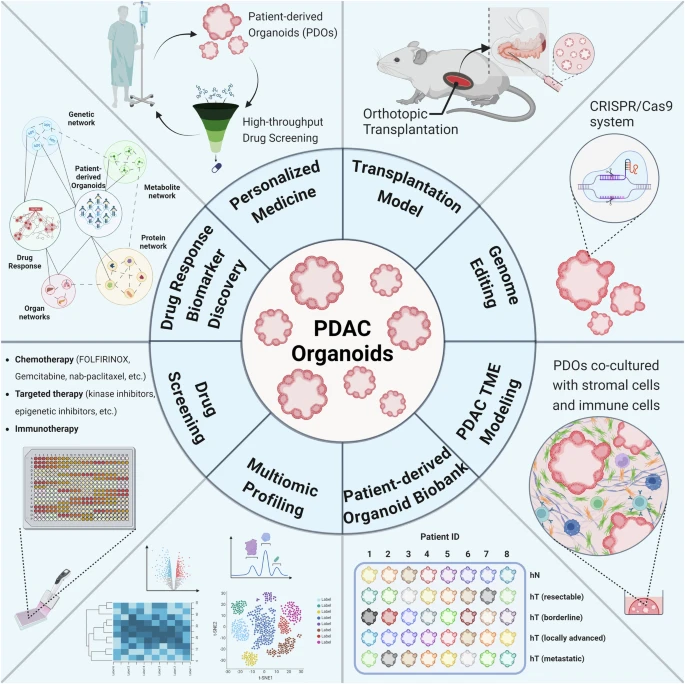
图8:PDAC类器官的应用方向
(来源:参考资料[2])
最重要的是,类器官还可参与肿瘤机制的解读。转移性PDAC与原发性肿瘤具有相似的突变景观,其转移特性主要由表观遗传等调控。例如,胰腺类器官已经协助揭示了转录因子(如FOXA1、EN1、EVI1和TEAD2)在PDAC转移表型中的影响[13]。澳大利亚胰腺癌基因组计划也已利用小鼠和人PDAC类器官鉴定了阶段特异性和亚型特异性DNA甲基化特征(图9)[14]。根据以上表观遗传发现,还可针对不同分子亚型开发全新诊断标志物。
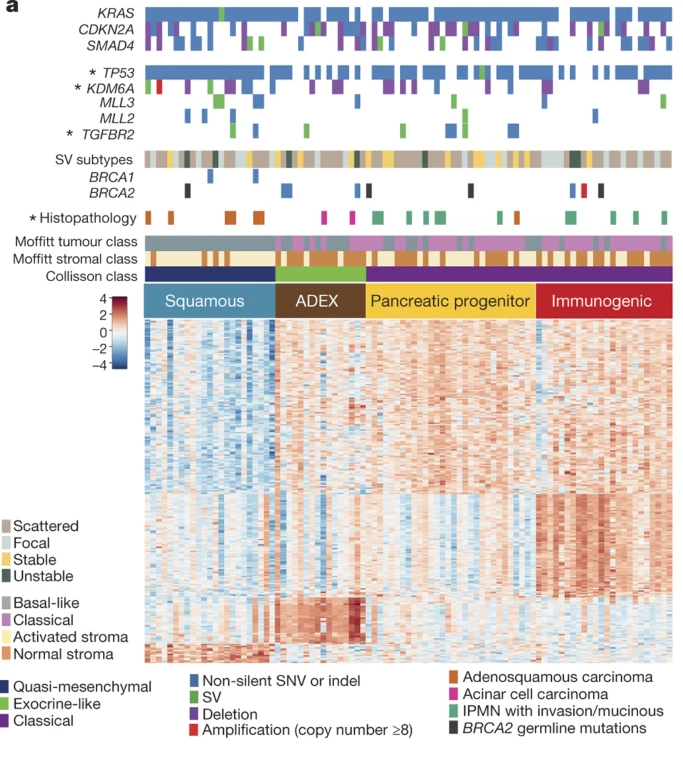
图9:RNA-seq对PDAC的聚类分析
(来源:参考文献[14])
04 挑战与改良
PDAC复杂的肿瘤微环境(TME)已对药物疗效造成了困扰。譬如,活化的肿瘤相关成纤维细胞(CAFs)与沉积的富含胶原蛋白的细胞外基质(ECM)在很大程度上阻碍了PDAC药物的有效递送。最近已开发了PDAC类器官和各种TME细胞组分,包括CAF及免疫细胞等的共培养模型,以进一步探索细胞间相互作用在肿瘤进展中的贡献,以及肿瘤发展过程中的免疫反应等。
PDAC还受上皮-间充质转化(EMT)等表型可塑性驱动,具有显著的肿瘤间和肿瘤内异质性。近日,德国慕尼黑工业大学研究团队首次成功建立了涵盖PDAC异质性全图景的人源类器官模型(图10)[15]。具体的培养方法包括去除培养基中的TGF-βRI抑制剂及Wnt3a等其他会增强上皮分化、抑制分支发生的因子,同时添加B27、FGF10、EGF、HGF、Noggin和Rspondin1等生长因子以及NAC及iCRT14等小分子。
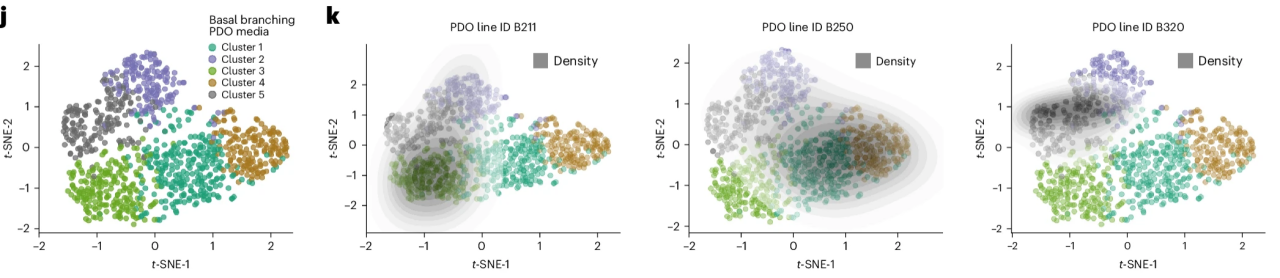
图10:PDO的表型异质性
(来源:参考文献[15])
低血管含量与缺氧环境也是PDAC的特征之一。与正常胰腺相比,PDAC组织的血流减少约60%。该特性同样限制了药物递送效率及化疗有效性。与此同时,血管形成可能促进转移和肿瘤进展。研究人员正在积极探索血管化PDAC类器官的生成,以进一步研究血管与PDAC的关系。韩国一研究团队通过将类器官与人脐带静脉内皮细胞(HUVEC)共培养形成血管微环境[16]。2020年,多伦多大学研究团队开发了PDAC器官器官芯片血管系统,可准确再现动态TME[17]。
05 总结
胰腺类器官已成为研究胰腺发育、稳态以及良性和恶性胰腺疾病的重要桥梁。事实上,不止胰腺癌,近年来胰岛类器官在生物工程和血管化技术方面的突破也已协助其在临床前模型中证明了逆转糖尿病的可行性[18]。不过,迄今为止尚未开发出同时包含内外分泌腺的胰腺类器官,这大大阻碍了对二者生理和病理的同时研究[19]。如何简化当前复杂的胰腺类器官培养系统以提高效率也是改良方向之一。尽管成果喜人,但目前胰腺类器官仍处于早期阶段,主要重点仍然是增强其仿生性。
